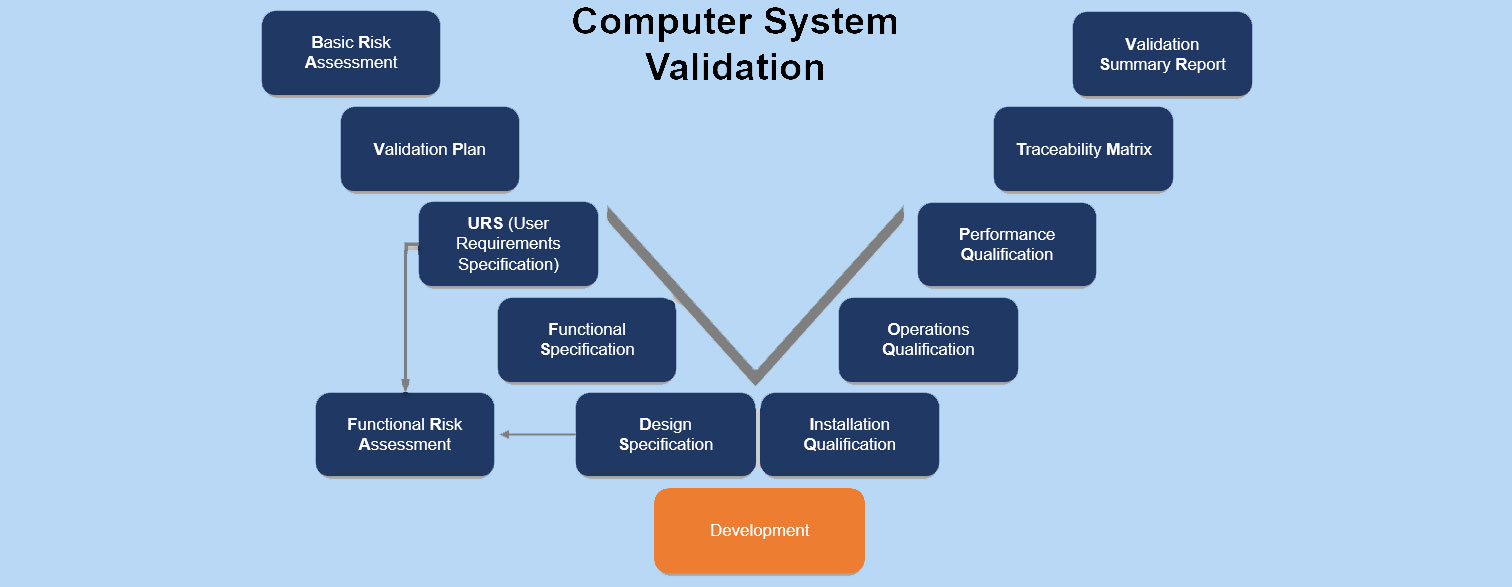
Validación de Sistemas Computarizados – CSV
La Validación de Sistemas Computarizados (CSV) es un proceso documentado que garantiza que un sistema informático hace exactamente lo que fue diseñado para hacer, de manera consistente y reproducible.
El proceso de validación proporciona evidencia documentada de que el sistema cumple de forma continua con los requisitos previamente definidos y es adecuado para su uso previsto. Las validaciones se utilizan en diferentes tipos de entornos regulados por GxP, tales como:
-
Esterilidad
-
Limpieza
-
Métodos analíticos
-
Validación de procesos
¿Por qué es importante la Validación de Sistemas Computarizados (CSV)?
La validación de sistemas computarizados es especialmente relevante para empresas farmacéuticas y fabricantes de productos sanitarios, ya que permite evaluar la transparencia, la calidad y la seguridad para el paciente en relación con el sistema utilizado. Los principios clave son:
-
Evitar peligros y riesgos para la salud y la vida humana
-
Prevenir fallos de producto y sus consecuencias para la salud y la vida de las personas
-
Garantizar productos de alta calidad mediante pruebas exhaustivas y una operación informática controlada
-
Minimizar el riesgo de fallos y errores mediante procesos de TI transparentes y una gestión de sistemas controlada
Al implementar la Validación de Sistemas Computarizados (CSV), usted garantiza además el cumplimiento de normativas nacionales e internacionales, y puede cubrir las siguientes directrices críticas:
-
ISO 13485, FDA 21 CFR 820, FDA 21 CFR Part 11, SFDA, entre otras
-
Procesos de fabricación fiables y seguros
-
Evidencia documentada de las actividades realizadas para cumplir con procesos críticos bajo los principios GxP (Buenas Prácticas de Manufactura, Laboratorio, Distribución, etc.)
Langfristig betrachtet hilft die Computer System Validation auch Kosten zu reduzieren:
- Geringer Wartungsaufwand durch Einsatz von Qualitäts- und Projektmanagementstandards
- Geringe Wartungsaufwände und Kosten im Change Management durch Transparenz und eine zuverlässige Systemdokumentation
- Geringe Kosten in der Entwicklung und Herstellung von Produkten durch Einsatz zuverlässiger Software und Prozesse
A largo plazo, la Validación de Sistemas Computarizados (CSV) también contribuye a reducir costos, gracias a:
-
Menores esfuerzos de mantenimiento mediante el uso de estándares de calidad y gestión de proyectos
-
Reducción de costes y esfuerzos en la gestión de cambios, gracias a la transparencia y a una documentación del sistema fiable
-
Disminución de costes en el desarrollo y fabricación de productos, mediante el uso de software y procesos confiables
-
IQ:
-
Cualificación de la Instalación de Hardware (Hardware Installation Qualification – IQ)
Es la evidencia documentada de que:-
El sistema ha sido diseñado y construido de acuerdo con su especificación
-
El sistema ha sido instalado correctamente
-
El sistema cumple con su propósito definido
-
La instalación es transparente
-
La instalación es repetible y reproducible
-
- La guía o política de instalación del sistema informático, incluyendo configuraciones y parámetros específicos de la empresa
- Se utiliza como lista de verificación y documentación para asegurar una instalación correcta
- Debe reutilizarse en cada instalación del sistema informático (por ejemplo, en estaciones cliente, etc.)
- Ofrece una estandarización del sistema informático y permite la reutilización de la documentación de validación en varios sistemas
- Cada instalación del sistema informático es idéntica, transparente, repetible y reproducibleCualificación de la Instalación de Software (Software Installation Qualification – IQ)
Consiste en:.
-
-
-
OQ:
-
Cualificación Operacional (OQ – Operational Qualification)
La Cualificación Operacional (OQ) se realiza una vez completados todos los protocolos de la Cualificación de Instalación (IQ). Su propósito es verificar que el rendimiento del equipo cumple con los requisitos definidos por el usuario y opera dentro de los límites especificados por el fabricante.En la práctica, esto significa que se deben identificar y probar las funciones del equipo que pueden tener un impacto en la calidad del producto final.Durante la OQ:
- Se evalúan todos los elementos del plan de pruebas
- Su funcionamiento se documenta exhaustivamente
- Solo puede llevarse a cabo después de finalizar la IQ, ya que es un requisito previo para la aceptación del equipo o sistema
En términos generales, la OQ sirve como una verificación detallada de:
- La puesta en marcha del hardware y software
- La operación del sistema
- Las rutinas de mantenimiento y limpieza
- Las medidas de seguridad (cuando sean aplicables)
Para cada unidad de hardware y software debe demostrarse que funciona correctamente dentro de los límites especificados.
-
-
PQ:
- Cualificación de Funcionamiento (PQ – Performance Qualification)La PQ representa el último paso en la cualificación de equipos. En esta fase, el equipo de cualificación y validación verifica y documenta que los equipos funcionan con resultados reproducibles dentro de un rango operativo definido, bajo condiciones simuladas que reflejan el entorno real de uso.A diferencia de fases anteriores, en la PQ no se evalúan los componentes de forma individual, sino que se prueban como parte de un proceso parcial o completo, lo que refleja con mayor fidelidad el uso real del sistema.Antes de iniciar la PQ:
- Es necesario elaborar un plan de pruebas detallado, basado en la descripción del proceso
- La calidad de la cualificación depende en gran medida de la calidad del plan de pruebas
- En esta etapa, la participación de un especialista externo puede ser recomendable para asegurar un alto nivel de precisión y exhaustividad
-
Protocolo de Cualificación del Desempeño del Proceso (PPQ). El PPQ es un elemento clave dentro de la validación y cualificación de procesos. Su objetivo principal es garantizar de forma continua la calidad del producto, documentando el rendimiento del proceso a lo largo de un período definido. Esto se logra evaluando si los procesos operan de forma estable, confiable y conforme a los estándares establecidos para la producción en serie.
- Cualificación de Funcionamiento (PQ – Performance Qualification)La PQ representa el último paso en la cualificación de equipos. En esta fase, el equipo de cualificación y validación verifica y documenta que los equipos funcionan con resultados reproducibles dentro de un rango operativo definido, bajo condiciones simuladas que reflejan el entorno real de uso.A diferencia de fases anteriores, en la PQ no se evalúan los componentes de forma individual, sino que se prueban como parte de un proceso parcial o completo, lo que refleja con mayor fidelidad el uso real del sistema.Antes de iniciar la PQ:
Nuestra gama de servicios
- Validación basada en riesgos
- Validación de componentes de software SAP y desarrollos propios en SAP
- Validación conforme a la norma ISO 13485
- Evaluación de riesgos
- Creación y ejecución de scripts de prueba
- Ejecución completa del proceso de validación
- Cualificación IQ / OQ / PQ
-
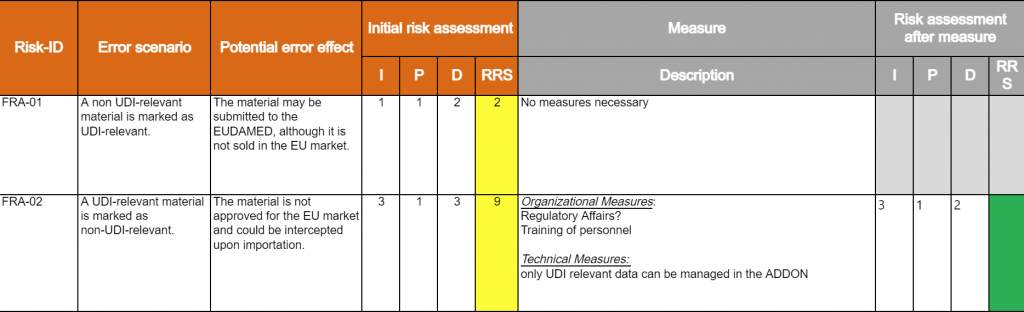
Gestión de Riesgos en la Validación de Sistemas Computarizados (CSV)
La gestión de riesgos es un componente esencial de la CSV, ya que garantiza la calidad y transparencia del sistema con respecto a los riesgos potenciales. En el marco de la Evaluación de Riesgos Funcionales (FRA), se evalúan los riesgos de cada función en relación con la seguridad del paciente, la calidad del producto y la integridad de los datos.
Durante esta evaluación de riesgos, se analizan diferentes escenarios de riesgo y se definen medidas de mitigación adecuadas para reducir dichos riesgos.
Las medidas de mitigación del riesgo deben definirse especialmente cuando:-
La probabilidad de ocurrencia es alta
-
El impacto en la seguridad del paciente, la calidad del producto o la integridad de los datos es significativo
-
Y cuando el riesgo no puede detectarse fácilmente dentro del caso de uso
En base a estos factores, el riesgo potencial puede ser calculado y priorizado.
-
Las medidas adecuadas para la reducción del riesgo pueden definirse en dos niveles:
Organizativo:
-
Aplicación de Procedimientos Operativos Estándar (SOP)
-
Capacitación y talleres sobre el uso seguro del software
Técnico:
-
Verificación de la validez de los datos (campos obligatorios, reglas de negocio)
-
Verificación de la integridad de los datos (validaciones cruzadas)
Si desea obtener más información sobre la Validación de Sistemas Computarizados, no dude en contactarnos para concertar una cita personalizada.
Estaremos encantados de asesorarle individualmente según sus necesidades.
Nehmen Sie Kontakt mit uns auf
Complemento SAP con plugins para EUDAMED, FDA, SFDA, TGA, NMPA y otras autoridades:
Nuestro Add-On UDI validado para SAP, junto con sus plugins, cumple con todos los requisitos de las autoridades regulatorias internacionales y representa una solución eficaz para la implementación del UDI a nivel global.