
EUDAMED, UDI und MDR verstehen: Ein Leitfaden für Hersteller von Medizinprodukten
In der Medizinprodukteindustrie ist die Einhaltung gesetzlicher Vorschriften entscheidend für die Gewährleistung der Patientensicherheit und der Produktqualität. Ein wichtiger Aspekt der Einhaltung von Vorschriften ist die Verfolgung und Meldung von Informationen über Medizinprodukte, einschließlich ihrer eindeutigen Identifizierung, Klassifizierung und Überwachung nach dem Inverkehrbringen. An dieser Stelle kommen die Konzepte von Eudamed, UDI und MDR ins Spiel.
Was ist Eudamed?
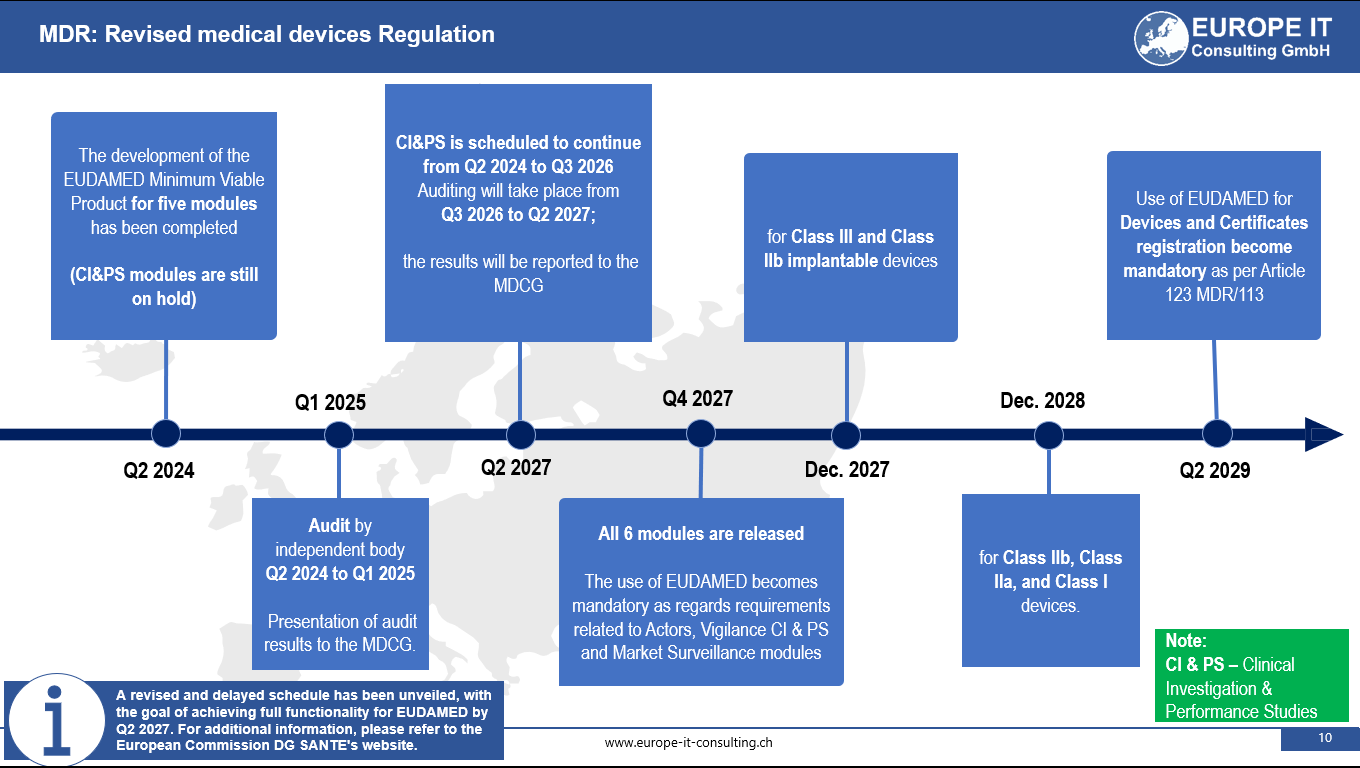
Eudamed (European Database on Medical Devices) ist eine elektronische Datenbank, die von der Europäischen Kommission (EC) im Rahmen der Umsetzung der Medizinprodukteverordnung (MDR) und der Verordnung über In-vitro-Diagnostika (IVDR) entwickelt wird. Eudamed wird als zentrale Datenbank für Informationen über Medizinprodukte dienen, die in der Europäischen Union (EU) in Verkehr gebracht werden.
Was ist UDI?
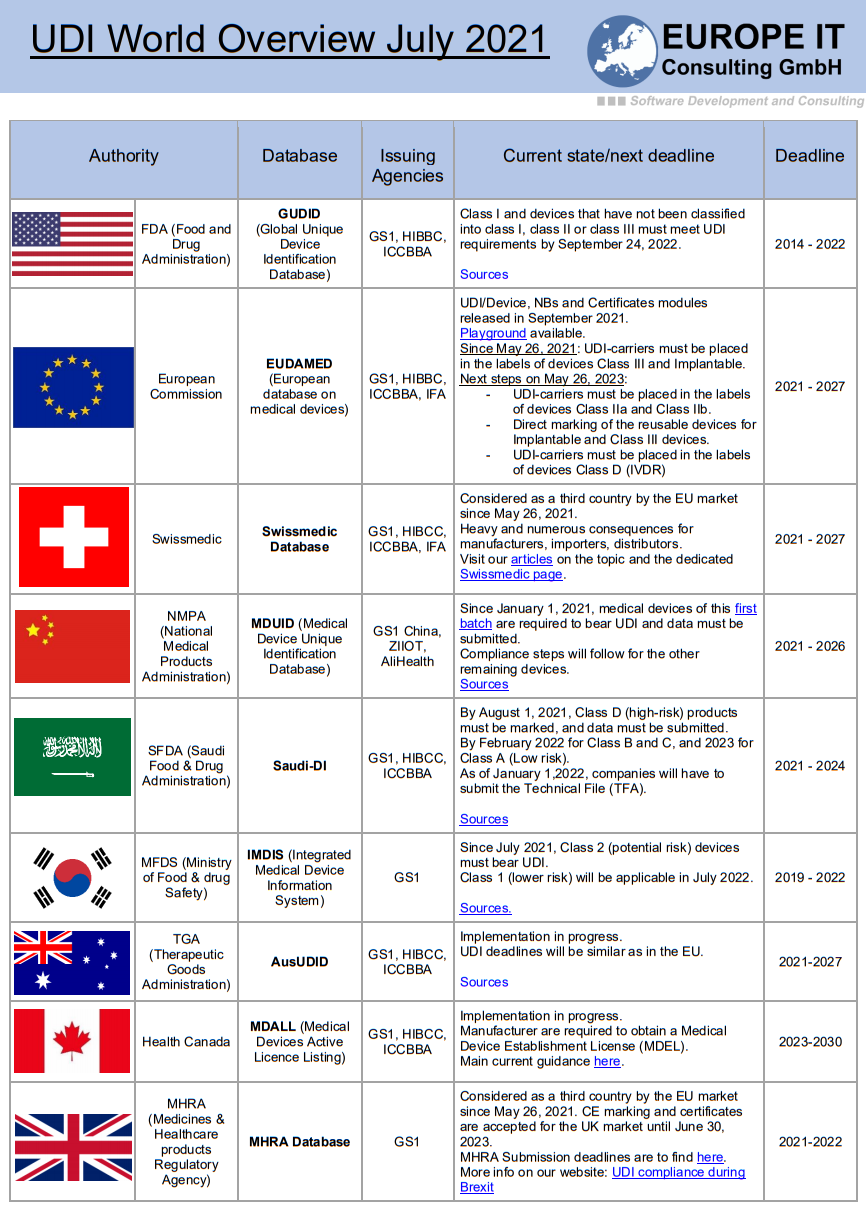
UDI (Unique Device Identification) ist ein System zur Kodierung und Kennzeichnung von Medizinprodukten mit einem eindeutigen Identifikator, der die Identifizierung und Rückverfolgbarkeit der einzelnen Produkte während ihres gesamten Lebenszyklus ermöglicht. UDI ist eine Schlüsselkomponente der MDR und soll die Patientensicherheit verbessern, indem es den Rückruf fehlerhafter oder problematischer Produkte erleichtert und die Identifizierung einzelner Produkte im Falle von Zwischenfällen ermöglicht.
Was ist die MDR?
Die MDR oder Medizinprodukteverordnung ist ein neuer Rechtsrahmen, der die Richtlinie über Medizinprodukte (MDD) und die Richtlinie über aktive implantierbare medizinische Geräte (AIMDD) in der EU ersetzt. Die MDR führt neue Anforderungen für Hersteller von Medizinprodukten ein, darunter die obligatorische Berichterstattung an Eudamed, die Verwendung von UDI und erhöhte Anforderungen an die klinische Evidenz, um nur einige zu nennen.
Durch die Kenntnis von Eudamed, UDI und MDR können Hersteller von Medizinprodukten sicherstellen, dass sie die neuesten Vorschriften vollständig einhalten und den Patienten in der EU sichere und wirksame Medizinprodukte zur Verfügung stellen können.






Related Posts