
Basel, Schweiz – Die Europe IT Consulting GmbH freut sich, einen bedeutenden Meilenstein in ihren fortlaufenden Bemühungen zur Unterstützung von Medizinprodukteherstellern bei der Einhaltung von Compliance- und Regulierungsanforderungen bekanntzugeben.
Wir haben erfolgreich über 107.000 UDI-DI Datensätze in die Europäische Datenbank für Medizinprodukte (EUDAMED) übertragen. Dieser Erfolg stellt einen wichtigen Schritt zur Sicherstellung der Rückverfolgbarkeit und Sicherheit von Medizinprodukten in ganz Europa dar.
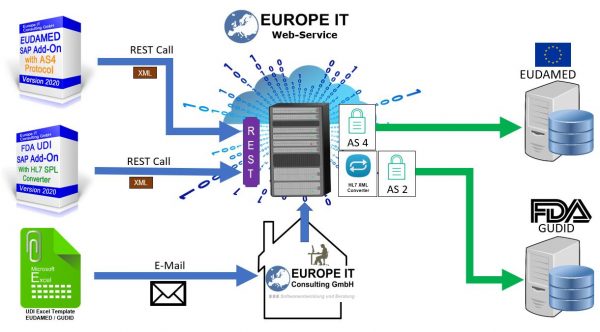
Der Prozess der Übertragung von UDI-DI-Daten zu EUDAMED ist eine komplexe und sorgfältige Aufgabe, die Präzision und Einhaltung strenger regulatorischer Standards erfordert. Wir stehen an der Spitze dieser Initiative und bieten unseren Kunden nahtlose und effiziente Lösungen für die Datenübermittlung. Unser Global UDI Add-On für SAP war entscheidend für das Management und die Pflege von UDI-Attributen und erleichterte die digitale Datenübertragung zu EUDAMED.
Beeindruckende Statistiken:
- 107.000 UDI-DI-Datensätze übertragen: Wir haben eine große Anzahl von UDI-DI-Datensätzen effizient übertragen und damit unsere Fähigkeit unter Beweis gestellt, groß angelegte Datenübermittlungen zu bewältigen.
- Zuordnung zu Basic UDI-DI: In der Regel liegt die Anzahl der UDI-DIs, die einem einzelnen Basic UDI-DI zugeordnet sind, zwischen 11 und 550. Es gab jedoch bemerkenswerte Fälle, in denen einem einzigen Basic UDI-DI über 1.600 UDI-DIs zugeordnet wurden, was die Variabilität und Komplexität der Geräteanmeldungen zeigt.
Die erfolgreiche Umsetzung der UDI-Übermittlungen an EUDAMED unterstreicht unser Engagement für Exzellenz und unsere führende Rolle im Bereich der Medizinprodukte-Compliance. Diese Leistung hebt nicht nur unser technisches Können hervor, sondern auch unser Engagement, die Patientensicherheit durch verbesserte Rückverfolgbarkeit von Medizinprodukten zu erhöhen.
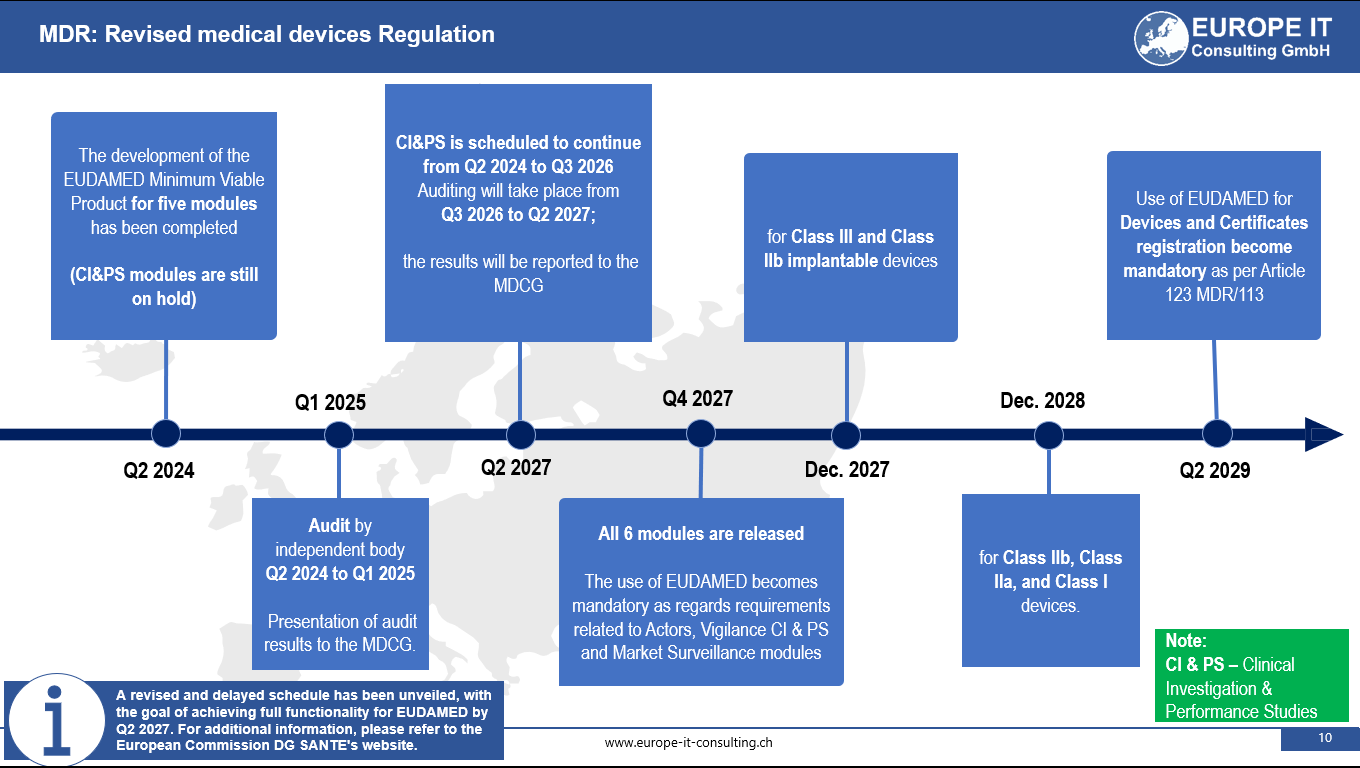
Über EUDAMED: EUDAMED ist ein wesentlicher Bestandteil der Medizinprodukteverordnung (MDR) und der Verordnung über In-vitro-Diagnostika (IVDR) der Europäischen Union. Ziel ist es, die Transparenz und Koordination von Informationen über Medizinprodukte, die auf dem EU-Markt erhältlich sind, zu verbessern. Die Datenbank umfasst mehrere miteinander verbundene Module, darunter die Registrierung von UDI/Devices und Benannten Stellen und Zertifikaten, die für die volle Funktionalität und regulatorische Compliance von Medizinprodukten in Europa unerlässlich sind.
Für weitere Informationen über unsere Dienstleistungen und unsere Global UDI Add-On-Lösung besuchen Sie bitte Europe IT Consulting GmbH.






Related Posts