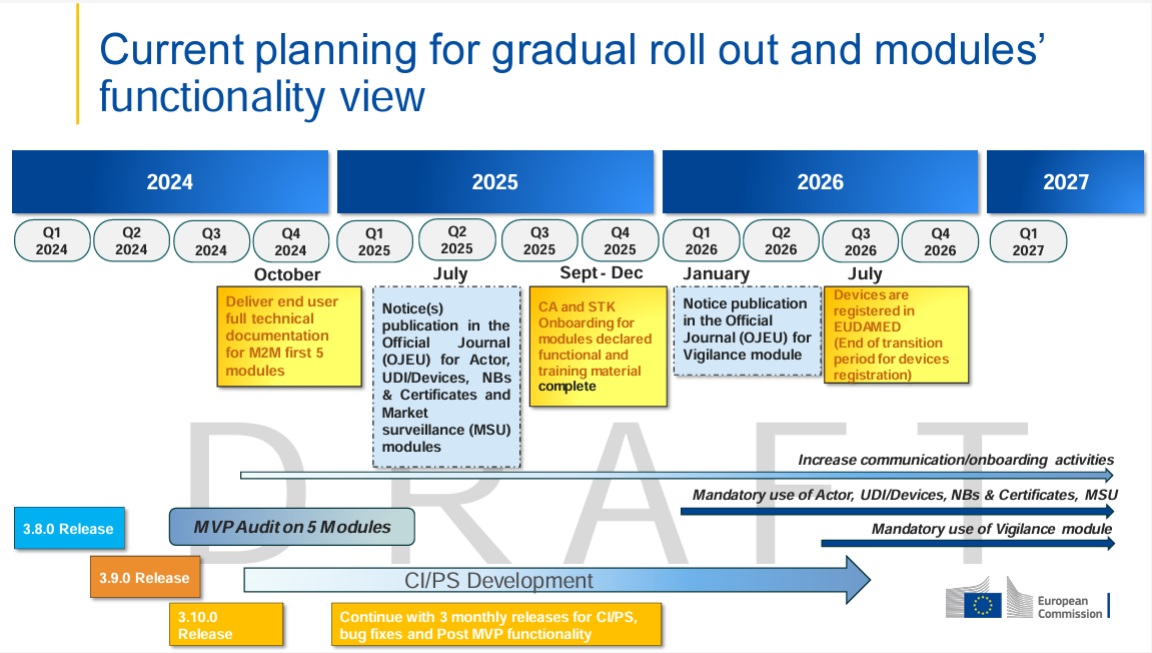
Wir möchten Sie heute über den neuesten Stand des Vigilance-Moduls in der EUDAMED-Datenbank informieren. Das Vigilance Modul der EUDAMED ist aktuell geplant im Jahr 2026 in Betrieb zu gehen. Dieses Modul ist von zentraler Bedeutung für Hersteller von Medizinprodukten und die Einhaltung regulatorischer Anforderungen.
Was ist Vigilance EUDAMED?
Das Vigilance-Modul der EUDAMED (Europäische Datenbank für Medizinprodukte) dient zur Erfassung und Meldung von Sicherheitsvorfällen, schwerwiegenden Vorkommnissen und Feldkorrekturmaßnahmen im Zusammenhang mit Medizinprodukten. Es ermöglicht Behörden und Herstellern eine transparente und effiziente Kommunikation von sicherheitsrelevanten Informationen.
Regulatorische Verpflichtungen und Compliance
Die Verwendung des Vigilance-Moduls ist für alle Hersteller von Medizinprodukten eine gesetzliche Pflicht im Rahmen der Medical Device Regulation (MDR). Hersteller müssen sicherstellen, dass sie allen Anforderungen zur Meldung von schwerwiegenden Vorkommnissen und Korrekturmaßnahmen nachkommen, um Strafen und mögliche Vertriebsbeschränkungen zu vermeiden.
Wie ist das Modul aufgebaut?
Das Vigilance-Modul wird es ermöglichen, Vorfälle und Maßnahmen elektronisch an die zuständigen Behörden zu melden. Hersteller müssen sicherstellen, dass alle sicherheitsrelevanten Daten in der vorgegebenen Form erfasst und eingereicht werden. Das Modul ist in verschiedene Abschnitte unterteilt:
- Meldung schwerwiegender Vorkommnisse: Detaillierte Angaben über Sicherheitsvorfälle, die zu gesundheitlichen Schäden führen könnten.
- Sicherheitskorrekturmaßnahmen: Informationen über Korrekturmaßnahmen, um Risiken zu mindern.
- Berichte und Rückmeldungen: Möglichkeit zur Nachverfolgung und Kommunikation von Statusberichten.
Ab wann ist das Vigilance-Modul aktiv?
Das Vigilance-Modul von EUDAMED wird voraussichtlich im ersten Quartal 2026 Live gehen und wir dann ab dem dritten Quartal verpflichtend sein. Hersteller sollten sich bereits jetzt darauf vorbereiten, um ab dem ersten Tag einsatzbereit zu sein.
Nächste Schritte:
Die Europäische Kommission hat eine Roadmap veröffentlicht, die den Zeitplan und die wichtigsten Meilensteine für die Einführung der verschiedenen EUDAMED-Module beschreibt. Wir empfehlen Ihnen, sich die Roadmap anzusehen, um besser vorbereitet zu sein. Hier geht es zur Roadmap.
Unterstützung und Vorbereitung:
Zur Vorbereitung auf die bevorstehende Einführung des Vigilance-Moduls empfehlen wir folgende Maßnahmen:
- Überprüfung und Optimierung der internen Prozesse zur Erfassung und Meldung von Vorkommnissen.
- Schulung der zuständigen Mitarbeiter in den neuen EUDAMED-Prozessen.
- Implementierung einer Softwarelösung, die die Erfassung und Meldung der Daten vereinfacht und mit den EUDAMED-Anforderungen kompatibel ist.
Wenn Sie Unterstützung bei der Umsetzung dieser Maßnahmen oder weitere Informationen benötigen, stehen wir Ihnen gerne zur Seite.
Konsequenzen bei Nichteinhaltung:
Hersteller, die ihre Verpflichtungen nicht erfüllen, könnten mit Sanktionen wie Geldstrafen oder Verkaufsbeschränkungen für ihre Produkte in der EU konfrontiert werden. Daher ist es wichtig, rechtzeitig alle Anforderungen zu erfüllen.













Related Posts