
SWISSDAMED – Das neue Schweizer UDI System
Das Abkommen über die gegenseitige Anerkennung (MRA), eines der wichtigsten Abkommen zwischen der EU und der Schweiz, das den bilateralen Handel in einer Reihe von Schlüsselsektoren zwischen der Europäischen Kommission und der Schweiz erleichtert, wurde nicht verlängert und lief daher im März 2021 aus.
Da jeder Hersteller von Medizinprodukten in der Schweiz einen bevollmächtigten Vertreter in der EU benötigt, musste eine neue Medizinprodukteverordnung namens „SWISSDAMED“ geschaffen werden, um eine eigene UDI-Datenbank aufzubauen.
Swissdamed – „Swiss Database on Medical Devices”
- Actor Database =>Herstellerregistrierung, um die CHRN-Nummer zu erhalten (vergleichbar mit SRN aus EUDAMED)
- UDI Database =>Enthält UDI-Daten (Struktur sollte ähnlich wie bei EUDAMED sein)
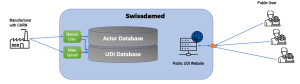
Überblick über das Swissdamed Datenbank
Anmeldung bei der Swissdamed
Registrierte Hersteller bei Swissmedic müssen sich nicht erneut für Swissdamed registrieren (CHRN wird bereits vergeben)
- Regulation EN:
- Medical Devices Ordinance (MedDO; SR 812.213)
- Vitro Diagnostic Medical Devices (IvDO; SR 812.219)
- Regulation DE:
- Medizinprodukteverordnung (MepV; SR 812.213)
- In-vitro-Diagnostika (IvDV; SR. 812.219)
- Anmeldeformular für Swissmedic / CHRN-Nummer:
- https://www.swissmedic.ch/swissmedic/en/home.webcode.html?webcode=BW630_11_001defi_FO
- Senden an E-Mail: chrn@swissmedic.ch
GoLive Swissdamed für 2023 geplant
-
Die Realisierung wird in 3 Phasen unterteilt
- Phase 1 : Registrierung der Hersteller (Actor module)
- Phase 2: Registrierung der UDI-Daten in Swissdamed (UDI module)
- Phase 3: Freigabe zusätzlicher Funktionalitäten für bestehende Module

Die 3 Phasen des Swissdamed Realisierungsprozesses
Startseite der Swissmedic
Auswirkungen der Medical Devices Ordinance (MepV) in der Schweiz
Konformitätskennzeichen und Identifikationsnummer
(MepV Art. 13 Konformitätskennzeichen und Identifikationsnummer) Produkte, die in der Schweiz in Verkehr gebracht oder auf dem schweizerischen Markt bereitgestellt werden, müssen ein Konformitätskennzeichen nach Annex 5 tragen.
Als Konformitätskennzeichen ist auch das Konformitätszeichen nach Anhang V EU-MDR18 zulässig. Neben dem in Annex V EU-MDR beschriebenen CE-Zeichen wird in Annex 5 der MepV auch ein nationales Konformitätszeichen beschrieben. Beide Zeichen sind zulässig.
Informationen zum Produkt
(MepV Art. Art. 16 Produktinformation) Die Produktinformation muss in drei Amtssprachen abgefasst sein. Artikel 16 regelt die Fälle, in denen die Produktinformationen in weniger als den drei Amtssprachen oder in Englisch abgefasst sein können (Absatz 3).
Implantat-ID
(MepV Art. 20 Informationen über implantierbare Produkte) Zusätzlich zu den Produktinformationen gemäss MepV Art. 16 und Art. 18 EU-MDR ist der Hersteller verpflichtet, dem Produkt eine Implantatkarte in den drei Landessprachen beizulegen.
Registrierung der Wirtschaftsbeteiligten
(MepV Art. 55 – Registrierung der Wirtschaftsbeteiligten) Herstellerinnen, deren Bevollmächtigte oder Importeurinnen melden sich innerhalb von drei Monaten nach dem erstmaligen Inverkehrbringen eines Produkts bei Swissmedic an. Anmeldeformular: Eindeutige Identifikationsnummer nach Art. 55 MepV (CHRN Swiss Single Registration Number)
Informationssystem für Medical Devices
(MepV Art. 2. Abschnitt: Informationssystem für Medizinprodukte – Art. 83ff) Die Artikel 83 – 92 beschreiben ein Informationssystem für Medical Devices. Swissmedic trägt die Verantwortung für dieses Informationssystem und ist für die Ausarbeitung eines Benutzerreglements zuständig. Die Daten können sowohl aus EUDAMED als auch aus den kantonalen elektronischen Systemen bezogen werden.
UDI-Symbole (Symbol auf dem Produkt oder auf dem Etikett)
Die Fristen für die UDI weichen nicht von der EU-MDR ab und sind wie folgt geregelt (MepV Art. 104 – Anbringung der UDI):
- für implantierbare Produkte und Produkte der Klasse III: ab 26. Mai 2021
- für Produkte der Klassen IIa und IIb: ab 31. Dezember 2027
- für Produkte der Klasse I: ab 31. Dezember 2028
Für wiederverwendbare Produkte, bei denen die UDI auf dem Produkt selbst anzubringen ist (Direktkennzeichnung): 2 Jahre nach den für die jeweilige Produktklasse angegebenen Daten.
Bevollmächtigter Vertreter (MepV Art. 104a Bestellung eines bevollmächtigten Vertreters)
Wenn ein Hersteller nicht in der Schweiz ansässig ist, dürfen seine Produkte nur in Verkehr gebracht werden, wenn eine in der Schweiz ansässige Person bevollmächtigt wurde.
Ein Bevollmächtigter muss innerhalb der folgenden Fristen beantragt werden:
- für Produkte der Klasse III,
- Implantierbare Produkte der Klasse IIb und aktive implantierbare medizinische Geräte: bis 31. Dezember 2021
- für nicht implantierbare Produkte der Klasse IIb und Produkte der Klasse IIa: bis zum 31. März 2022
- für Produkte der Klasse I: bis zum 31. Juli 2022








Related Posts