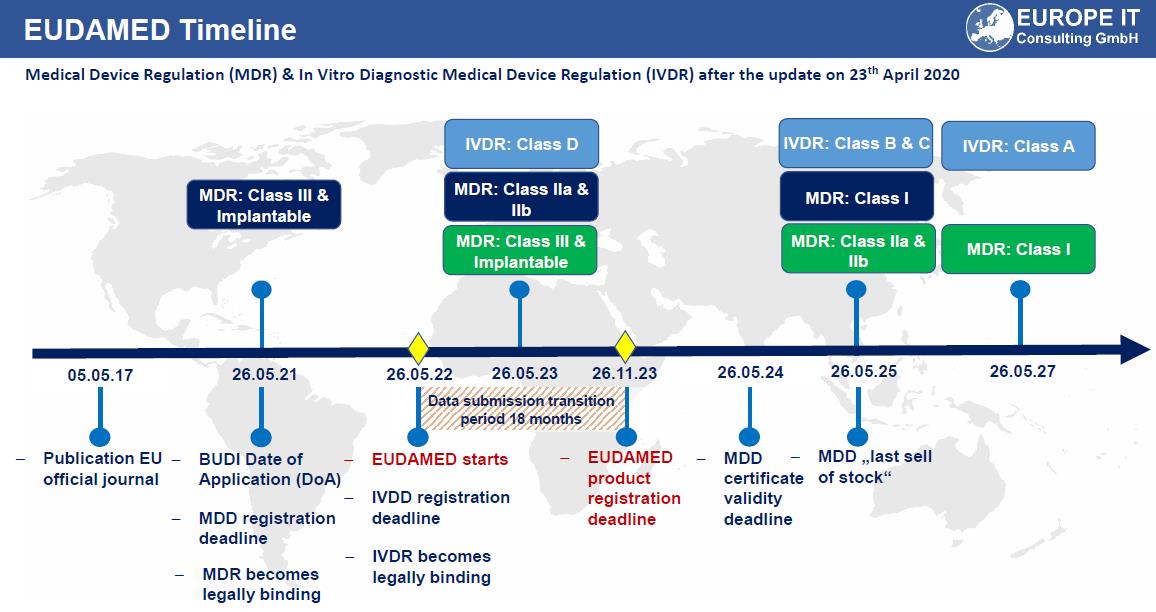
Die Initiative zur eindeutigen Produktidentifizierung von Medizinprodukten und In-vitro-Diagnostika ist jetzt ein international heißes Thema, und wie Sie als Hersteller darauf reagieren, wird Ihr Geschäft in den kommenden Jahren beeinflussen.
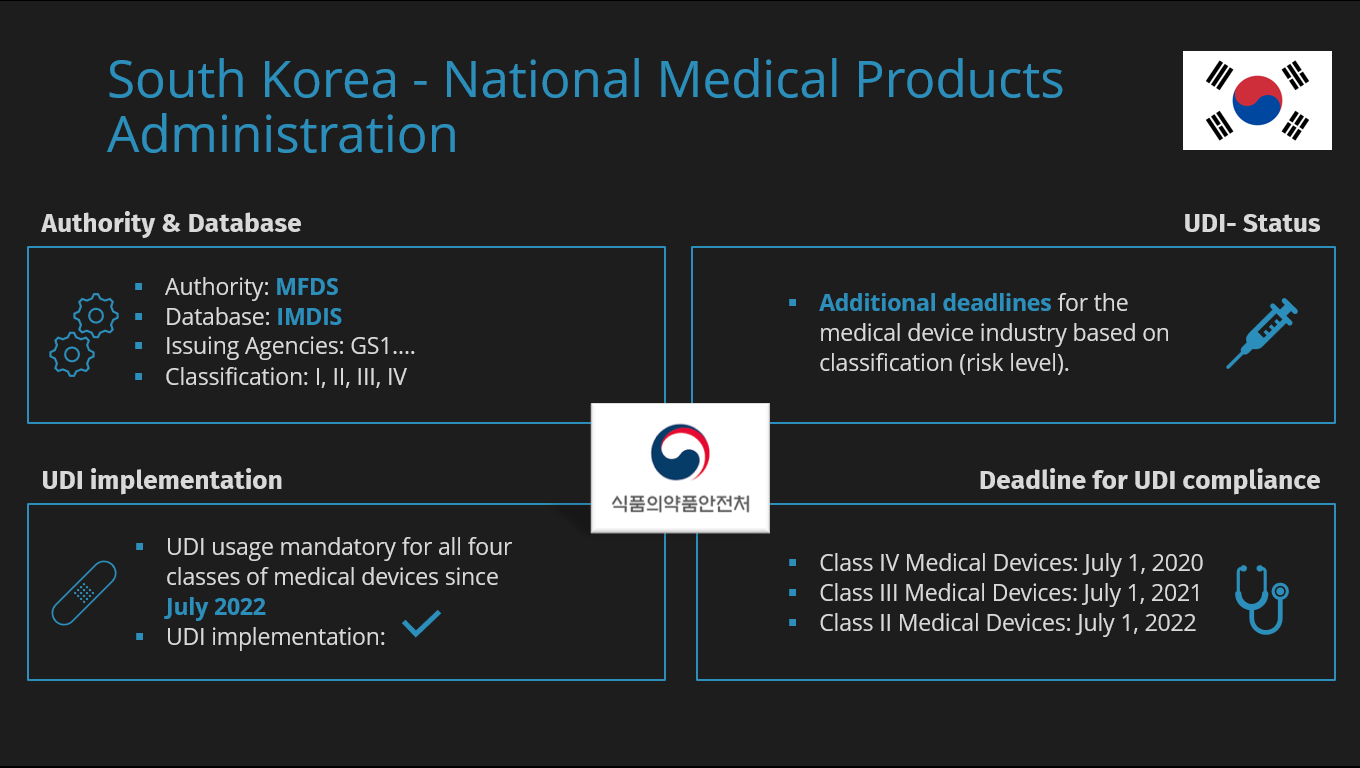
Regulatorische Anforderungen zur eindeutigen Produktidentifizierung begannen in den USA, breiteten sich auf die Europäische Union aus und werden nun auch in Südkorea, Saudi-Arabien, China und anderswo eingeführt. Parallel dazu beginnen Ihre kommerziellen Geschäftspartner damit, ihre Verträge zu überarbeiten, um festzulegen, dass die eindeutige Gerätekennzeichnung auf den Produkten angebracht und in elektronisch veröffentlichte Produktkataloge aufgenommen werden muss.
Das Video: https://youtu.be/TBPjH5RSKvs







Related Posts