
A’dan Z’ye Tıbbi Endüstride UDI Terimleri ve Kısaltmaları.
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
A
AIDC: Otomatik Tanımlama ve Veri Yakalama
AIDC sistemleri, ürünlerin üretimini, lojistiği, taşımayı ve dağıtımını destekleyebilir, ürün ve cihazların takibini üstlenebilir ve işaretleme ile tanımlamalarını kontrol edebilir.
AIDC teknolojileri, ürünlerin barkodlar ve 2D kodlar ile grafiksel olarak işaretlenmesini içerir.
AIMDD
Aktif İmplant Edilebilir Tıbbi Cihaz Yönergesi (MDR tarafından değiştirilecek).
AS2 Protokolü: Uygulanabilirlik Beyanı 2
AS2 protokolü, Elektronik Veri Değişimi (EDI) iletim standartlarından biri olan en popülerlerindendir. İş dünyasında yaygın olarak kullanılmasının nedeni, AS2’nin İnternet’i iletişim kanalı olarak kullanmasıdır. Bu nedenle protokol, özel bir ağın kullanımına bağlı değildir. İnternet üzerinden iletim için AS2, hem HTTP hem de HTTPS protokollerini kullanır.
AS4 Protokolü: Uygulanabilirlik Beyanı 4
AS4 Protokolü, ticari ortaklar arasında iş-toiş mesajların güvenli bir şekilde değiştirilmesi için Web hizmetleri tabanlı bir iletişim protokolüdür. Protokol, OASIS (Yapılandırılmış Bilgi Standartları Geliştirme Organizasyonu) teknik komitesi tarafından ebXML Mesajlaşma Hizmetleri için onaylanmıştır. AS4, web hizmetleri yeteneğiyle bulut tabanlı iletişim standardı olma şansına sahiptir.
Otorize Temsilci
Yetkili temsilci, başka bir kişi adına bir beyanla veya bunu alarak hareket eden ve karar veren temsilcidir.
Yetkili temsilcinin tanımı, hakları ve görevleri MDR’nin 11. bölümünde açıklanmıştır.
Daha fazlasını oku >>MDR Yetkili Temsilcisi<< Daha fazlasını oku >>UDI Rolleri<<B
Temel UDI-DI Kodu
Temel UDI-DI, bir ürün grubunun ortak özelliklerini özetler.
Budi
Temel UDI-DI’yi kısaltmak için kullanılır.
C
CA: Yetkili Kurum
Tıbbi cihazların onaylanmasından sorumlu ajans.
Daha fazlasını okuKlinik Araştırma
“Herhangi bir insan üzerinde veya içinde, bir veya birden fazla insan üzerinde yapılan, bir tıbbi cihazın güvenliği ve/veya performansını değerlendirmek amacıyla yapılan sistematik bir araştırma veya çalışma” olarak tanımlanır (SG5/N1:2007).
Bu, söz konusu cihazın güvenliği ve klinik performansını değerlendirir ve cihazın amaçlandığı (EN ISO 14155-1:2009) amaç(lar) ve popülasyon(lar) için uygun olup olmadığını değerlendirir. AB’ye yerleştirilen cihazlar hakkında klinik araştırma hakkında daha fazla bilgi için MDR’nin VI. Bölümünü okuyun.
CND: Ulusal Tıbbi Cihaz Sınıflandırması
İtalyan sistemi, İngilizce olarak “National Classification of Medical Devices” olarak adlandırılan, EUDAMED’e tıbbi cihazların kaydı için başvuruda bulunmuştur. Orada EMDN olarak adlandırılır.
Kod 128
Kod128, yüksek bilgi yoğunluğuna sahip alfasayısal bir barkoddur. Temel yapısı, başlangıç karakteri, kullanıcı bilgisi, kontrol rakamı ve durdurma karakterinden oluşur. Başlangıç karakterinden önce ve durdurma karakterinden sonra beyaz bir alan (açık alan veya sessiz bölge) serbest bırakılmalıdır.
Kritik Uyarılar
Cihazın kullanıcısının dikkatini çekmesi gereken alınması gereken uyarılar veya önlemler ve diğer herhangi bir kişiye. Bu bilgi, bu durumda daha ayrıntılı bilgilerin kullanım talimatlarında yer alması durumunda dikkate alınarak minimumda tutulabilir. (Kaynak: Tıbbi Cihaz Yönetmeliği 2017/745, Ek I, 23.2 etikette bulunması gereken bilgiler hakkında)
Örneğin: “yutulduğunda: derhal tıbbi tavsiye/alın”, “kuru olduğunda patlayıcı”, “göz temasında toksik”. Daha fazla bilgi için makalemizi okuyun Depolama/Kullanma Koşulları ve Kritik Uyarılar Hakkında Detaylar
CSDT: Ortak Başvuru Dosya Şablonu
ASEAN belgesi, ASEAN üye ülkelerinin tıbbi cihaz düzenleyici otoritelerine tıbbi cihaz bilgilerinin ortak bir şablonunu sunmak için tasarlanmıştır. İşte bu şablon hakkında ASEAN rehberliği.
Özel Üretim Cihazı
– ulusal hukukun verdiği yetkiye dayanarak belirli bir kişi tarafından yazılı bir reçeteye uygun olarak yapılan cihaz
– o kişinin sorumluluğunda sağlanan belirli tasarım özelliklerine sahip cihaz
– yalnızca belirli bir hastanın koşullarını ve ihtiyaçlarını karşılamak üzere tasarlanan cihaz.
– Ürün “seri üretilmiyorsa” (otomatize edilmiş mekanik bir süreçle büyük miktarlarda üretilmiyorsa), üreticiler CMD’leri üretmek için modern teknolojileri kullanabilir.
Daha fazla bilgi için bu konuda ayrılmış makalemizi okuyun: MDR’ye (2017/745) Göre Özel Üretim Cihazı (CMD).
D
DataMatrix Barkodu
DataMatrix kodu en bilinen 2D kodlardan biridir. Kalıcı doğrudan işaretleme, ayrıca belge işleme içinde yazılı kod görüntüsü olarak kullanılır.
Dimdi
Alman Tıbbi Belgeler ve Bilgiler Enstitüsü, Sağlık Bakanlığı’na bağlı bir otoriteydi.
Dağıtıcı (MDR’ye Göre)
Distribütörlerin tanımı, hakları ve yükümlülükleri MDR’nin 14. bölümünde açıklanmıştır.
Daha fazlasını okuDI: Cihaz Tanımlayıcı
Cihaz için (statik) ürün tanımlama verileri, GTIN gibi.
DM: Doğrudan İşaretleme
Bir cihaz tanımlama numarası. Örneğin GTIN14 numarası veya HIBC numarası.
DPM: Doğrudan Parça İşaretleme
Etiket olmadan bir ürünün işaretlenmesi. Örneğin cerrahi aletlerde seri numarasının lazerle kazınması.
DUNS: Veri Evrensel Numaralandırma Sistemi
DUNS numarası, Dun & Bradstreet tarafından geliştirilen ve uluslararası düzeyde şirketlerin benzersiz tanımlanması için bir standart olarak kullanılan sayısal bir kodtur.
E
EMDN
Avrupa Tıbbi Cihazlar Nomenklatürü, EUDAMED’e kayıt sistemi olarak yerleşmiştir.
ESG: Elektronik Başvuru Kapısı
Gıda ve İlaç İdaresi’nin Elektronik Başvuru Kapısı, elektronik başvuruların kabulü için kurumsal çözümdür. FDA ESG, endüstri standardı protokollerini kullanarak belgelerin ve başvuruların çeşitli tiplerini işlemek için FDA ve ortakları için güvenli, ölçeklenebilir, hızlı erişilebilir ve güçlü bir değişim noktasıdır. FDA ESG, inceleme için ön pazar ve son pazar düzenleyici bilgilerinin güvenli bir şekilde gönderilmesini sağlar.
FDA ESG, başvuruların FDA’ya gönderilmesi için WebTrader ve AS2 olmak üzere iki yöntem sunar.
EUDAMED: Avrupa Tıbbi Cihazlar Veri Tabanı
Avrupa Birliği’ndeki tıbbi cihazların kaydedilmesi için veritabanı. Yeni Tıbbi Cihaz Yönetmeliği’nin tanıtımının bir parçası olarak veritabanının yeni bir sürümü kullanıma sunulacaktır.
EURL: AB Referans Laboratuvarı
Avrupa Komisyonu tarafından belirlenen laboratuvarlar, bazı yüksek riskli ve IVD tıbbi cihazları için görüşler ve görüşler sunmak üzere atanmış ve Avrupa Komisyonu veya MDCG gibi aktörlere danışmanlık yapma rolüne sahiptir. EURL’lerin görevleri, Tıbbi Cihaz İn Vitro Tanı Yönetmeliği’nin 100. maddesinin 2. ve 3. fıkralarında tanımlanmıştır.
F
FDA
ABD FDA, Amerika Birleşik Devletleri Gıda ve İlaç İdaresi’dir. Bu nedenle, Amerika Birleşik Devletleri Sağlık ve İnsan Hizmetleri Bakanlığı’na rapor verir.
Link: https://www.fda.gov/
FSCA: Alan Güvenliği Düzeltici İşlemi
Bir cihaz sahibi tarafından, piyasada zaten bulunan bir tıbbi cihazın kullanımıyla ilişkilendirilen ölüm riskini veya ciddi sağlık bozulmasını azaltmak için alınan herhangi bir önlem.
FSCA hakkında EUDAMED’de detaylı bilgi için MDR’nin 87. Maddesi’ne ve IVDR’nin 82. Maddesi’ne başvurun.
G
GDSN
Global Veri Senkronizasyon Ağı (GDSN), dünya çapında kullanılan veri iletimi için internet tabanlı bir sistemdir. GDSN, ticaret ortakları arasında değiş tokuş edilen verilerin dünya çapında GS1 standartlarına uygun olduğunu sağlar.
Link: https://www.gs1.org/services/gdsn
GHTF: Tıbbi Cihazlar İçin Küresel Uyumlaştırma Görev Gücü
Küresel Uyumlaştırma Görev Gücü, “tıbbi cihazlar için ulusal düzenleyici otoritelerin temsilcilerinden oluşan gönüllü bir grup” idi ve amacı tıbbi cihazların düzenlemesinin dünya çapında standartlaştırılmasıydı. Üyeleri endüstriden oluşuyordu.
GHTF, 2012 yılının sonunda dağıldı. Rolü, dünya çapındaki düzenleyici otoritelerden yetkililerin oluşturduğu bir devam örgütü olan Uluslararası Tıbbi Cihaz Düzenleyiciler Forumu (IMDRF) tarafından devralındı. GHTF web sitesi artık işlevsel değil.
GMDN: Küresel Tıbbi Cihaz Nomenklatürü
GMDN kodu, FDA veritabanı olan GUDID’de tıbbi cihazların kaydedilmesi için gereklidir.
Link: https://www.gmdnagency.org/
GS1
GS1, dünya çapında şirketler arası süreçler için standartları geliştiren, müzakere eden ve sürdüren kar amacı gütmeyen kuruluşlar ağıdır. Tıbbi cihazların benzersiz ürün tanımlaması bağlamında UDI tahsis sistemi için tahsis organı olarak atanmışlardır.
Link: https://www.gs1.org/
GTIN
Global Ticari Ürün Numarası, ticaret birimlerinin işaretlenebileceği GS1 sistemi (önceden EAN sistemi) türetilmiş bir tanımlama numarasıdır.
GUDID
Global Benzersiz Cihaz Tanımlama Veritabanı, FDA tarafından yönetilen, her bir cihaz için benzersiz bir cihaz tanımlayıcısı (UDI) olan bir referans katalog görevi gören bir veritabanıdır.
GUDID Productiv bağlantısı: https://gudid.fda.gov/gudid/app/login.xhtml
GUDID PreProd bağlantısı: https://gudid.preprod.fda.gov/gudid/
H
HIBC: Sağlık Endüstrisi Barkodu
Ürünlerin tanımlanması için hizmet veren dünya çapında benzersiz bir numara.
Link: https://www.hibcc.org/
HL7
Sağlık Seviye 7, sağlık organizasyonları ve bilgisayar sistemleri arasında veri alışverişi için uluslararası standartlar grubudur.
Daha fazlasını okuI
ICCBBA: Kan Bankacılığı Otomasyonunda Ortaklık için Uluslararası Konsey
ICCBBA, resmi olarak Dünya Sağlık Örgütü (WHO) ile resmi bir ilişkisi olan uluslararası, kar amacı gütmeyen, hükümet dışı bir standardizasyon kuruluşudur ve ISBT 128 standardının yönetimi ve geliştirilmesinden sorumludur. İnsan kökenli tıbbi cihazların terminolojisi, kodlaması ve etiketlenmesi için uluslararası bilgi standardını yönetir, geliştirir ve lisanslar. ICCBBA, UDI alanında bir verme ajansı olarak hareket eder.
Link: https://www.iccbba.org/
IFA – Arzneispezialitäten Bilgi Merkezi
“Farmasötik özel bilgi merkezi”
IFA GmbH, 6 Haziran 2019 tarihli uygulama kararı ile AB Komisyonu tarafından UDI-DI için tahsis organı olarak belirlenmiştir. IFA kodlama sistemi doğrultusunda ambalaj üzerinde kodlanmış bir Eczacılık Ürün Numarası (PPN), bu şekilde MDR uyumlu bir UDI-DI’yi temsil eder.
Link: http://www.ifaffm.de/en/home.html
IMDRF: Uluslararası Tıbbi Cihaz Düzenleyici Forum
Uluslararası Tıbbi Cihaz Düzenleyici Forum, tıbbi cihaz düzenlemelerinin uyumlaştırılması için gelecekteki yönergeleri belirlemek amacıyla Şubat 2011’de tasarlandı.
Bu, dünyanın dört bir yanından tıbbi cihaz düzenleyici organlarının gönüllü bir grubudur ve tıbbi cihaz düzenlemesinin uluslararası uyumlaştırılmasını hızlandırmak için Küresel Uyumlaştırma Görev Gücü’nün (GHTF) güçlü temelini oluşturmak üzere bir araya gelmişlerdir.
Link: http://imdrf.org/
İthalatçılar
İthalatçıların tanımı, hakları ve yükümlülükleri MDR’nin 13. bölümünde açıklanmıştır.
Daha fazlasını okuVerme Ajansı
Verme Ajansı, tıbbi cihazlar için benzersiz cihaz tanımlaması çerçevesinde UDI tahsis sisteminin işleyişinden sorumludur. GS1, HIBCC ve diğerleri gibi tanınmış verme ajansları bulunmaktadır.
Daha fazlasını okuIVD: Vitro-Diagnostik
İn vitro tanı tıbbi cihazları, insan vücudundan alınan örneklerin tıbbi laboratuvar incelemesi için kullanılan bir terimdir. Bunlar vücut dışında (Latince in vitro ‘cam içinde’) incelenir.
IvDD
In Vitro Diagnostik Yönergesi (IVDR tarafından değiştirilecek).
IVDR: İn Vitro Diagnostika Yönetmeliği
Yeni Avrupa İn Vitro Diagnostik Tıbbi Cihazları Yönetmeliği, mevcut İn Vitro Diagnostik Yönergesi’ni değiştirir. 25.05.2017 tarihinden itibaren geçerlidir.
Natürlich, hier ist der übersetzte Text:
“`html
MDSAP: Tıbbi Cihaz Tek Denetim Programı
MDSAP tanınmış bir Denetim Kuruluşunun, programa katılan düzenleyici otoritelerin ilgili gereksinimlerini karşılayan bir tıbbi cihaz üreticisinin tek bir düzenleyici denetimini yapmasına olanak tanır. Üyeleri: Avustralya, Brezilya, Kanada, Japonya, FDA. AB, İngiltere ve WHO yalnızca resmi gözlemcilerdir.
M2M: Makine-Makine
Makine-makine, makineler, otomatlar, araçlar veya konteynerler gibi terminal cihazlar arasında bilgi değiş tokuşunun otomatikleştirilmesini temsil eder; bu, genellikle internet ve mobil telefon ağı gibi çeşitli erişim ağları kullanılarak yapılır.
N
NANDO
Yeni Yaklaşım Bildirilmiş ve Atanmış Organizasyonlar (Örneğin, TÜV Süd gibi Bildirilmiş Kuruluş).
Link: https://ec.europa.eu/growth/tools-databases/nando/
NDC: Ulusal İlaç Kodu
Ulusal İlaç Kodu (NDC), ABD’deki insan kullanımı için olan ilaçlar için kullanılan benzersiz bir ürün tanımlayıcıdır. 1972 İlaç Listeleme Kanunu, kayıtlı ilaç tesisiyle, ticari dağıtım için ürettiği tüm ilaçların güncel bir listesini Food and Drug Administration (FDA) ile sağlamalarını gerektirir. İlaç ürünleri, NDC kullanılarak tanımlanır ve rapor edilir.
Bildirilmiş Kuruluş
AB’nin Bildirilmiş Kuruluşları, devlet tarafından bildirilen ve denetlenen özel denetim kuruluşlarıdır (denetim ve sertifikasyon kuruluşları); çeşitli türdeki endüstriyel ürünlerin üreticilerinin uygunluk değerlendirmesini kontrol etmek ve eşlik etmek üzere üreticiler adına hareket ederler.
Daha fazlasını oku
O
Optik Karakter Tanıma (OCR)
OCR, taranmış kağıt belgeler, PDF dosyaları veya dijital kamera ile yakalanan görüntüler gibi farklı türdeki belgeleri düzenlenebilir ve aranabilir veriye dönüştürmek için kullanılan bir teknolojidir. UDI ve etiketleme bağlamında OCR, etiketlerden bilgi yakalamak ve dijitalleştirmek için kullanılabilir.
Sahip / İşletici
ABD FDA UDI yönetmeliklerinde bu terim, bir cihazın üretiminden, tekrar paketlenmesinden, tekrar etiketlenmesinden ve dağıtımından sorumlu olan kuruluşu ifade eder.
On-etiket dışı kullanım
Bu, bir tıbbi cihazın (veya ilacın) onaylanmamış bir endikasyon veya onaylanmamış bir yaş grubu, dozaj veya uygulama yolunda kullanılması anlamına gelir. Bu kavram, etiketleme hakkında yapılan tartışmalarda ortaya çıkabilir, çünkü etiketlerin bir ürünün onaylanmış kullanımlarını doğru bir şekilde yansıtması gereklidir.
OEM (Orijinal Ekipman Üreticisi)
Tıbbi cihazlar bağlamında OEM, başka bir üretici tarafından pazarlanabilecek parçaları ve ekipmanları üreten bir şirkettir. OEM, düzenleyici gereksinimlere bağlı olarak UDI ve etiketleme konusunda belirli yükümlülüklere sahip olabilir.
İhmal Yönetimi
Bu, bir cihazın yapımında kullanılan bazı bileşenlerin veya malzemelerin eskimiş veya kullanımdan kalkmış olabileceği bir cihazın ömrü boyunca cihazın mevcut düzenlemelere uygun kaldığından emin olma pratiğidir. Bu, düzenlemeler değiştikçe UDI veya etiketleme güncellemeleri içerebilir.
P
Eczane Ürün Numarası (PPN)
İlaç Bilgi Ajansı (IFA “Arzneispezialitäten Bilgi Merkezi”), eczacılık sektöründe mevcut olan her ulusal numaralandırma sistemine yönelik Ürün Kayıt Ajansı Kodu (PRA-Kodu) çıkarır. Eczane Ürün Numarası (PPN), fark
lı numaralandırma sistemlerini uyumlu hale getirmek için tanıtıldı; bununla birlikte, sağlık sektöründeki ambalajlama etiketleme ve muhasebe sistemlerinde ulusal madde numaralarını korur. Bu, 2011/62/AB Direktifi’ne uyum sağlamak için kullanılır, bu da tıbbi ürünlerin sahteciliğe karşı güvenliğini artırmak için yapılmıştır. Bu sistemin özü, her numaralandırma sistemine benzersiz bir önek, PRA kodu, atamaktır. Manuel giriş ve veri değişiminde numaradaki hataları algılamak için iki haneli bir kontrol hanesi eklenir. Yeni numaraya Eczane Ürün Numarası denir. Alman Eczane Ürün Numarası (PZN “Pharmazentralnummer”) PRA kodu “11” olarak atanır, Avusturya PRA kodu “16” olarak atanır. Bu, mevcut ulusal kodlama sistemlerinin korunmasına izin verir.
PI: Üretim Tanımlayıcı
Üretim verileri (dinamik), üretim tarihi, son kullanma tarihi, parti numarası, seri numarası vb. gibi bir cihaz için.
PRA-Kodu: Ürün Kayıt Ajansı Kodu
Bir eczacılık alanındaki her ulusal numaralandırma sistemine yönelik “Arzneispezialitäten Bilgi Merkezi” (IFA) tarafından atanan bir kod. Bu, Eczane Ürün Numarası (PPN) ‘nin bir parçasıdır.
İşlem Paketi (MDR 2017/745’e göre)
MDR’nin 1. Bölümü, 2. Madde, 10. Fıkra’da, “işlem paketi” terimi aşağıdaki gibi açıklanmıştır:
‘işlem paketi’, belirli bir tıbbi amaç için bir araya getirilmiş ürün kombinasyonudur ve pazarlama amacıyla piyasaya sürülür
PZN: Pharma Zentral Nummer
Eczane Merkezi Numarası (PZN), Almanya genelinde eczanelerde yaygın olarak kullanılan ilaçlar, tıbbi cihazlar ve diğer ürünler için bir tanımlama anahtarıdır. Paketleme etiketleme ve muhasebe sistemlerinde ulusal madde numaralarını korurken farklı numaralandırma sistemlerini uyumlu hale getirmek amacıyla tanıtılmıştır. İsim, dozaj formu, etken madde gücü ve paket boyutuyla ilaç ürünlerini açıkça tanımlayan eksi işaretinden önceki sekiz haneli bir numaradır (7 haneli + kontrol hanesi). Metin olarak basılır (numaralar) ve her farmasötik pakette “PZN” olarak önce gelirken, çubuk kodu (Code39) olarak da basılır; bu durumda, “PZN” karakter dizisi çubuk koduna dahil edilmez.
Q
YYS: Kalite Yönetim Sistemi
Bir kalite yönetim sistemi, bir şirket yönetimi yöntemidir. Amaç, sistemli bir kalite yönetimidir.
QM: Kalite Yönetimi
Ekonomi içinde, kalite yönetimi, sürecin kalitesini, iş kalitesini ve dolayısıyla ürün ve hizmet kalitesini iyileştirmek için hizmet eden bir fonksiyon (yönetim) ve tüm organizasyonel önlemler olarak kabul edilir.
QR-Kodu
QR Kodu (Hızlı Tepki, bir ticari marka terimi olarak “QR Kodu”), 1994 yılında Japon şirketi Denso Wave tarafından geliştirilen iki boyutlu bir koddur (barkod). Otomatik hata düzeltmesi nedeniyle bu yöntem çok dayanıklıdır ve bu nedenle yaygın olarak kullanılır.
QS: Kalite Sistemi
Tıbbi cihaz üreticilerinin Food and Drug Administration (FDA) tarafından bir kalite sistemi oluşturması gereklidir. Bu, ürünlerinin her zaman geçerli gereksinimlere ve özelliklere uygun olduğundan emin olmak içindir. FDA tarafından düzenlenen ürünler için (gıda, ilaçlar, biyolojik ürünler ve cihazlar) kalite sistemlerine GMP (İyi Üretim Uygulamaları) denir.
R
REST Hizmeti
Temsilci Durum Transferi, kısaca REST, Web hizmetleri için modern bir programlama paradigmasıdır. AWS, VMware, Azure ve diğer bulut sağlayıcıları bugün neredeyse yalnızca REST’e dayanmaktadır. Daha az kaynak gerektirir ve kullanımı daha kolaydır. Avrupa IT Consulting GmbH’nin GUDID veritabanına UDI ile ilgili verilerin transferi için kullandığı iletişim hizmeti bu yönteme dayanmaktadır.
RFID
RFID veya transponder, görünmez r
adyo frekansı kimlik teknolojisi için yaygın terimlerdir. Radyo frekansı kimlik “elektromanyetik dalgaların yardımıyla kimlik belirleme” anlamına gelir ve nesnelerin ve canlı varlıkların otomatik ve temasız tanımlama ve konumlandırma için bir verici-alıcı sistemi için kullanılır.
Bir RFID sistemi, nesnenin veya canlı varlığın üzerinde bulunan ve tanımlayıcı bir kod içeren bir transpondörden ve bu kodu okumak için bir okuyucudan oluşur.
S
Yazılım Sürümü
Ticari olarak mevcut olan ve bu nedenle bağımsız bir tıbbi cihazı temsil eden herhangi bir yazılım, UDI gereksinimlerine tabidir. Bu durumda, yazılım sürümü, UDI-PI’de görüntülenen ilgili bir tanımlama unsuru olarak hizmet eder.
Daha fazlasını okuSRN: Tek Kayıt Numarası
Tek Kayıt Numarası, Tıbbi Cihaz Yönetmeliği veya EUDAMED bağlamında ekonomik operatörleri benzersiz bir şekilde tanımlamak için kullanılır.
Steril
Bir malzeme, nesne, sıvı, yüzey veya belirli bir ortam, tüm mikroorganizmaların, virüslerin, bakterilerin, prionların ve plazmidlerin miktarının öldürüldüğü veya hayatta kalan kalıntının belirli bir sınıra düştüğü şekilde tanımlanır. Sterilite, UDI ile ilgili veri toplanırken dikkate alınması gereken özelliklerden biridir.
Depolama ve Kullanım Koşulları
EUDAMED için, cihaz için gereken depolama ve kullanma koşulları. Örneğin: “kesmeyin”, “kapalı bir kap içinde saklayın”, “su ile teması önleyin”.
FDA için bunlar “Depolama ve Kullanma Türleri” olarak adlandırılır.
Daha fazla bilgi için makalemizi okuyun: Depolama/Kullanma Koşulları ve Kritik Uyarılar Hakkında Ayrıntılar
T
Üçüncü Taraf
Europe IT Consulting GmbH, FDA’ya veri iletimi bağlamında üçüncü taraf olarak hareket eder. Harici bir hizmet sağlayıcısı olarak, üçüncü taraf GUDID veritabanına veri transferini üstlenebilir.
U
UDI: Benzersiz Cihaz Tanımlaması
Bir (tıbbi) cihazın dünya çapında benzersiz şekilde tanımlanmasına hizmet eder.
UDI-DI ve TEMEL UDI-DI
Tam olarak bir ürünün özelliklerini tanımlar ve tam olarak bir TEMEL-UDI’ye sahiptir.
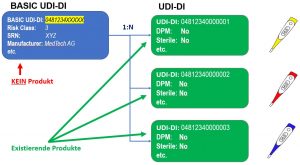
Kullanım Birimi DI
Kullanım Birimi DI, bir temel paketin içindeki birden fazla cihazı içeriyorsa, temel paket seviyesindeki UDI tanımlaması yapılmadığında, bireysel bir tıbbi cihaza atanmış sanal bir tanımlayıcıdır. Amacı, temel paketin birden fazla cihaz içerdiği durumda bir cihazın kullanımını/bir hastaya uygulanmasını ilişkilendirmektir.
V
Doğrulama
Tıbbi cihaz üretimi ve MDR bağlamında doğrulama, bir sürecin, sistemin, malzemenin, yöntemin veya ürünün belirtilen gereksinimleri karşıladığını doğrulama sürecidir. Bu, tıbbi cihazların kullanım için güvenli ve amaçlandığı gibi çalışması için önemlidir.
Dikkat
Bu terim, MDR bağlamında kullanılır ve zaten piyasada bulunan tıbbi cihazların güvenliğinin sürekli olarak izlenmesi sürecini ifade eder. Dikkatin amacı, bir tıbbi cihazla ilişkilendirilmiş herhangi bir sorunu veya riski hızlı bir şekilde belirlemek ve gerekirse zamanında düzeltilmesini sağlamaktır.
Onay
UDI ve MDR bağlamında onay, bir ürünün, sistemin veya bileşenin belirtilen gereksinimleri kar
şıladığına dair resmi bir beyandır. Bir ürünün onaylanması, o ürünün pazara sürülmesi için gerekli bir adımdır.
Ürün Türü (MDR 2017/745)
Ürün türü, MDR’nin 9. Maddesi kapsamında aşağıdaki gibi tanımlanmıştır:
‘ürün türü’, cihazın tasarımını, bileşenlerini ve teknolojisini belirler ve bu, üretici tarafından belirlenen ve izlenen bir sürecin sonucudur
W
Sahteciliği Önleme
FDA tarafından getirilen Gıda, İlaç ve Kozmetik Yasası’nın bölüm 717’si uyarınca, HCT / P, doku, insan doku ürünleri ve tıbbi cihazlara yönelik bir cihaz tanımlama gerekliliği mevcuttur. Buna ek olarak, Federal Hapishane ve Emeklilik Düzenlemesi (2019/796) kapsamında sahteciliği önlemek için Avrupa genelinde tıbbi cihazların tanımlanmasına yönelik gereksinimler getirilmiştir.
Zorunlu Zaman
Bir cihazın etiketlemesi gereken zamanın bir örneği. Örneğin, bir cihazın üretim tarihi, son kullanma tarihi gibi bilgileri içerir. Avrupa IT Consulting GmbH, bu bilgilerin düzenlenmesi ve depolanması için çözüm sunar.
Yasal Temsilci
Bir yasa veya düzenlemenin yürütülmesinden, örneğin AB Medikal Cihaz Yönetmelikleri’nden sorumlu olan gerçek veya tüzel kişi. Avrupa IT Consulting GmbH, tıbbi cihaz üreticileri için yasal temsilci hizmeti sunar.
Z
BMEnz: Avrupa Birliği Tıbbi Cihaz Yönetmeliği
AB yönergelerinin hukuki olarak bağlayıcı olduğu ve AB düzenlemeleri ile benzer şekilde uygulanması gerektiği anlamına gelir.
“`
Hoffentlich hilft Ihnen das weiter! Lassen Sie mich wissen, wenn Sie weitere Hilfe benötigen.