
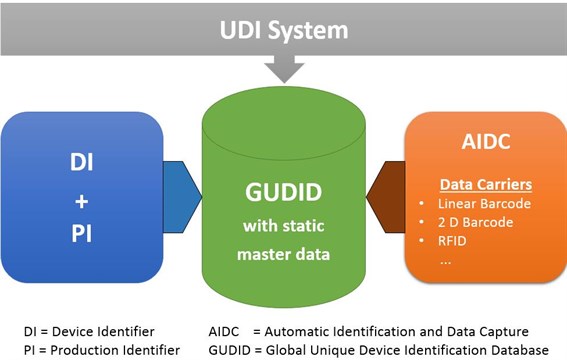
Die Einführung der Unique Device Identification (UDI) bedeutet, dass die Hersteller von Medizinprodukten verpflichtet sind, den Gesundheitsbehörden wie EUDAMED eine umfassende Palette von Produktinformationen bereitzustellen. Dieser Schritt wurde unternommen, um die Identifizierung, Rückverfolgbarkeit und Überwachung von Medizinprodukten zu verbessern und gleichzeitig Fälschungen entgegenzuwirken.
Obwohl das System in vielen Bereichen eine Verbesserung ermöglicht, bringt es auch zahlreiche Komplikationen mit sich. Die strengeren Kontrollrichtlinien der Europäischen Kommission führen zu Engpässen bei medizinischen Produkten. Diese Entwicklung verdeutlicht die bürokratischen und finanziellen Herausforderungen, mit denen die Hersteller konfrontiert sind. Insbesondere die steigende Anzahl von Anfragen in Verbindung mit begrenzten personellen Ressourcen erschwert die Bewältigung der steigenden Nachfrage.
MDR bremst Innovation aus und führt zu Lieferengpässen
Medical Mountains, ein Netzwerk im Bereich Medizintechnik und Life Sciences mit Sitz in Tuttlingen, in der auch Ismail Demiralp (CEO Europe IT Consulting) als Referent tätig ist, führte in Zusammenarbeit mit dem Industrieverband Spectaris und der Deutschen Industrie- und Handelskammer (DIHK) eine Umfrage durch. Diese ergab, dass viele befragte Unternehmen aufgrund langer und kostenintensiver Zertifizierungsprozesse unter Druck stehen, was dazu führt, dass immer mehr Produkte vom Markt verschwinden. Aufgrund dieser Herausforderungen entscheiden sich viele Hersteller dafür, bestimmte Produkte nicht mehr weiterzuentwickeln oder auf den Markt zu bringen. Insbesondere Nischenprodukte sind davon betroffen.
Ein weiteres Problem ist, dass in 20 % der Fälle keine Alternativen zu den vom Markt genommenen Produkten existieren, was schwerwiegende Folgen hat und die Gesundheit der Patienten konkret gefährdet. Außerdem haben die verschärften Kontrollrichtlinien negative Auswirkungen auf Innovationsaktivitäten. Als Folge davon werden Produkte nicht mehr optimiert oder verbessert.
Viele Unternehmen wenden sich nun der FDA zu und erwägen, den US-amerikanischen Markt zu bevorzugen. Da der Zulassungsprozess der FDA eine größere Planungssicherheit bietet und weniger bürokratische Hindernisse aufweist als die Zulassung in der EU, entscheiden sich Unternehmen, ihre Produkte in Zukunft nur auf diesem Markt zu verkaufen.
Ein deutliches Beispiel für die Unterschiede in den Zulassungsverfahren sind Ballonkatheter. In Deutschland kostet die Zulassung eines solchen Ballonkatheters 45-mal mehr als in den USA (3.000 US-Dollar in den USA und 135.000 Euro in Deutschland). Zudem dauert die Zulassungszeit bei der FDA weniger als 30 Tage, während sie in Europa 18 bis 24 Monate beträgt.
Europäische Hersteller haben bereits ihre Beschwerden geäußert, aber bisher gab es keine spürbaren Veränderungen. Diese Entwicklung bedroht nicht nur das Überleben hochinnovativer Unternehmen in Europa, sondern stellt auch eine potenzielle Gefahr für die Sicherheit der Patienten dar.
Die Lösung von Europe IT Consulting GmbH
Durch unsere Erfahrungen und Kenntnissen aus zahlreichen SAP Entwicklungsprojekten sind wir in der Lage eine individuelle und optimale Lösung für Ihr Unternehmen zu finden und diese zu implementieren.
Unsere Lösung unterstützt Sie dabei, Ihre UDI-relevanten Produkte in SAP zu pflegen und in den Datenbänken für Medizinprodukte zu übertragen.
Für weitere Informationen rund um UDI :




Related Posts