Die Einführung des UDI-Systems weltweit stellt Hersteller vor die Herausforderung, die Regulierungen der Unique Device Identification (UDI) einzuhalten. Diese Pflichten sind vielschichtig und der Weg zur Compliance äußerst komplex. Die UDI-Anforderungen variieren von Behörde zu Behörde, was eine kontinuierliche Herausforderung für Unternehmen darstellt.
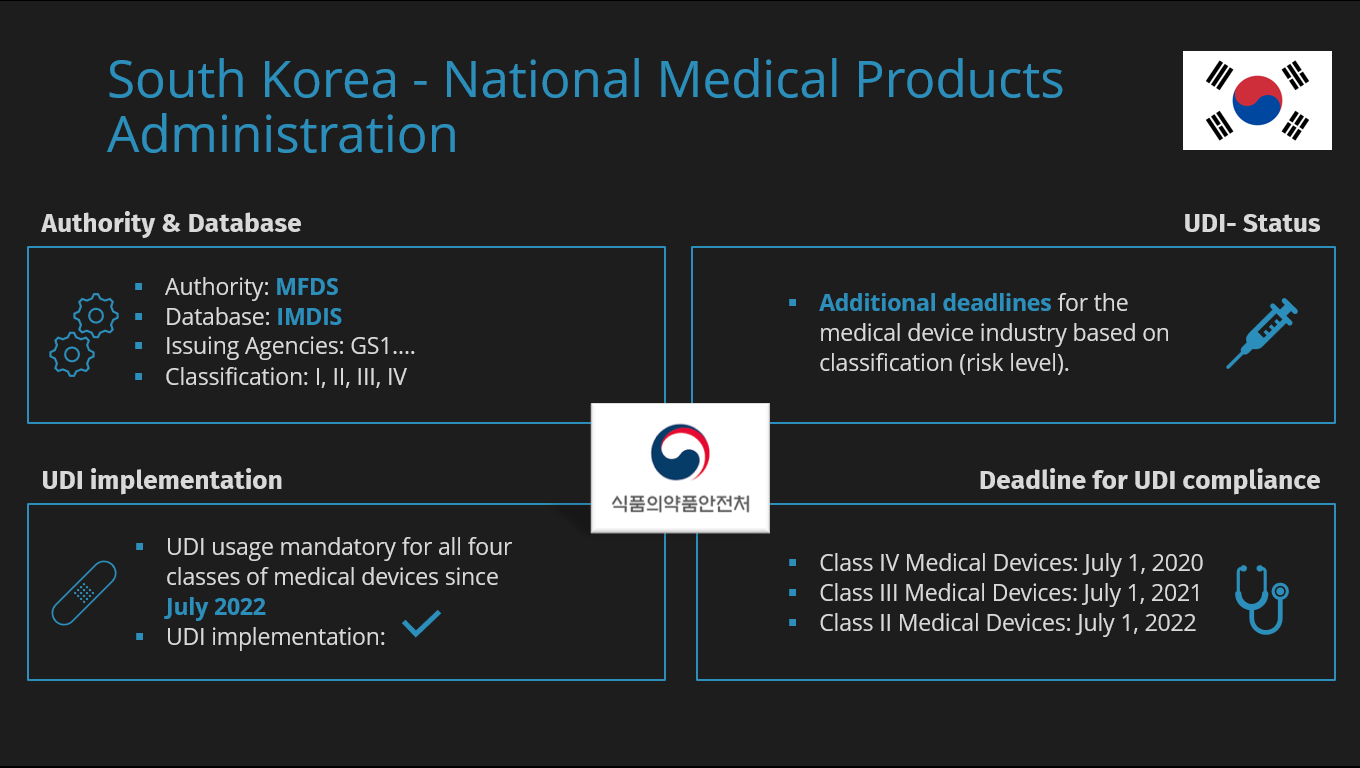
Dazu gehört auch die südkoreanische Medical Food and Drugs Safety (MFDS), die Institution in Süd-Korea, die für die Regulierung und Überwachung von Medizinprodukten und Gesundheitsprodukten zuständig ist.
Ihre Hauptaufgabe besteht darin, die Sicherheit, Genauigkeit und Wirksamkeit dieser Produkte zu gewährleisten. Dies umfasst den gesamten Lebenszyklus, angefangen bei der Herstellung über den Import bis hin zur Registrierung für den südkoreanischen Markt.
| Land | Behörde | Klassifizierung
(niedrig-hoch) |
|
 |
Süd-Korea | MFDS (Ministry of Food and Drug Safety) | I, II, III, IV |
In Süd-Korea werden Medizinprodukte in 4 Klassen eingeteilt. Diese Risikoklassen gehen von I bis IV und werden von niedrig bis hoch klassifiziert.
| CLASS | RISK LEVEL | BEISPIEL |
|---|---|---|
| I | VERY LOW | Mikroskop, Handschuh, Operationstisch, usw. |
| II | LOW | MRT, Pulsoximeter, Sterilisator, usw. |
| III | MODERATE | Kryochirurgisches System, Anästhesiesystem, Kondom, usw. |
| IV | HIGH | Implantierbarer Defibrillator, Wirbelsäulenscheibe, Intraokularlinse usw. |
IMDIS : Die Datenbank der MFDS
Wie auch andere Behörden besitzt die MFDS ihre eigene Datenbank, um Informationen zu verwalten und Datenübertragungen zu ermöglichen. Die sogenannte IMDIS, Integrated Medical Device Information System, soll allen Beteiligten die Möglichkeit geben, Informationen über Medizinprodukte mithilfe des eindeutigen Geräteidentifikationscodes zu identifizieren, der im System registriert ist.
|
MFDS |
|
|---|---|
| Name der MFDS UDI Datenbank |
IMDIS |
| Link zu der MFDS UDI Datenbank |
https://emedi.mfds.go.kr |
| Aktueller Status der IMDIS Datenbank | Live |
UDI- Timeline
- Class IV medical devices: July 1, 2020
- Class III medical devices: July 1, 2021
- Class II medical devices: July 1, 2022
- Class I medical devices: July 1, 2023
WICHTIG :
Es muss ein separater Supply Reports (Track & Trace) eingeführt werden, der monatlich eingereicht werden muss.
Ein lokaler Vertreter „South Korea License Holder“ muss ernennt werden der für die Erstellung des IMDIS-Kontos verantwortlich ist und die regulatorische Verantwortlichkeiten im Namen des Herstellers trägt.
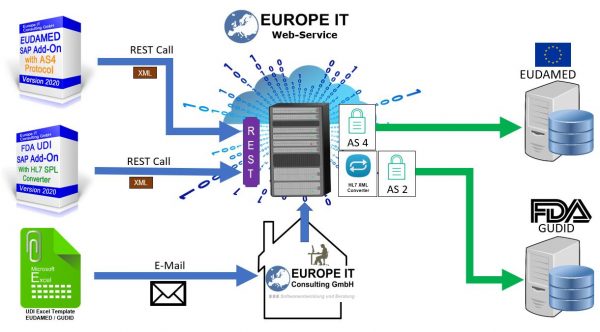
Sie wollen über Vorschriften und Fristen auf der ganzen Welt auf dem Laufenden sein! Europe IT Consulting stellt ihnen eine weltweite Übersicht zur Verfügung:
Technischen Anforderungen und Datenfelder der IMDIS
Die Europe IT Consulting GmbH hat die folgende Tabelle erstellt, um Ihnen einen Überblick über die technischen Voraussetzungen für den UDI-Prozess zu geben.
| Technische Anforderungen und Datenfelder |
|---|
| 1. Identification |
| – Primary Device ID |
| – Product/Model Name |
| – Software Version |
| – Barcode Labeling System |
| – Additional Information (URL) |
| 2. Hersteller |
| – Manufacturer/Importer License Number |
| – Manufacturer/Importer Name |
| – Manufacturer/Importer Address |
| – Consumer Support Center Name |
| – Consumer Support Center Phone |
| – Consignment Company Name/Address |
| – Foreign Manufacturer Name/Address |
| 3. Regulierung |
| – Article Name |
| – Class |
| – Approval, Certification, or Reporting Number of the Article (Article Group) |
| – Date of Approval, Certification, or Reporting |
| – Tracking & Control |
| – Integrated Information Officer’s Phone |
| – Integrated Information Officer’s Email |
| – Health Services under Article 41(3) of the National Health Insurance Act |
| – Health Service Code |
| 4. Sicherheitsinformationen |
| – Contains Latex |
| – Contains Phthalates |
| – MRI Safety Status |
| – Sterile Device |
| – Sterile Required |
| – Sterilization Method |
| – Other Sterilization Methods |
| 5. Verpackung |
| – Number of Devices |
| – Package DI |
| – Kit: Respective Name & Class |
| – Combined: Respective Name & Class |
| 6. Eigenschaften |
| – Implantable |
| – Disposable |
| – Storage Method |
| – Distribution & Handling Conditions |
| 7. Produktion |
| – Lot/Batch Number |
| – Serial Number |
| – Manufacturing Date |
| – Expiry Date |







Related Posts