Die asiatischen Länder, die sich durch eine starke wirtschaftliche Entwicklung auszeichnen, regulieren Schritt für Schritt das Regelungsumfeld für Medizinprodukte und implementieren die UDI.
Daher ist es gut zu wissen, wo diese Länder bei der Regulierung stehen. Aus diesem Grund geben wir hier einen Überblick über die wichtigsten Informationen zu 15 asiatischen Ländern.
Die meisten dieser Länder haben Vorschriften, die mit der Richtlinie über Medizinprodukte (AMDD) der ASEAN (Association of Southeast Asian Nations) übereinstimmen. In jedem Fall müssen ausländische Unternehmen einen bevollmächtigten Vertreter (Authorized Representative, AR) ernennen, der die Registrierung beantragt und je nach Land bestimmte Aufgaben delegiert.
Da es für jedes Land viele Besonderheiten gibt, gehen wir hier nicht ins Detail, sondern stellen den offiziellen Link für weitere Informationen zur Verfügung.
Erläuterung der Abkürzungen:
- UDI: Unique Device Identification = Eindeutige Gerätekennzeichnung
- CSDT: Common Submission Dossier Template (Gemeinsame Vorlage für das Dossier). Dieses Dokument soll eine gemeinsame Vorlage für die Einreichung von Informationen über Medizinprodukte bei den Behörden der ASEAN-Mitgliedsländer bieten. Siehe ASEAN-Anleitung hier.
- GHTF: Global Harmonization Task Force
| Land | Behörde | Klassifizierung
(niedrig-hoch) |
Stand der UDI Link für weitere Informationen |
|
 |
Bangladesch | Directorate General of Drug Administration (DGDA) | A, B, C, D | UDI nicht implementiert
Registrierungsanforderungen auf der Grundlage der GHTF-Dokumente. Weitere Informationen hier. |
| Kambodscha | Department of drugs and Food (DDF) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Technische Dokumentation gemäß der CSDT. Weitere Informationen here. |
|
 |
China | National Medical products Administration (NMPA) | I, II, III | UDI implementiert
Für die Registrierung ist eine Zulassung auf dem Markt des Heimatlandes erforderlich. Weitere Informationen here. |
 |
Indien | Central Drugs Standard Control Organization (CDSCO) | A, B, C, D | UDI wird ab dem 1. Januar 2022 für alle in Indien verkauften Medizinprodukte verpflichtend sein
Für die Registrierung ist eine Zulassung auf dem Markt des Heimatlandes erforderlich. Weitere Informationen here. |
 |
Indonesien | Ministry of Health (MoH) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Technische Dokumentation gemäß der CSDT. Je nach Art des Produkts muss die Risikoklasse unabhängig bestimmt werden. Weitere Informationen here. |
 |
Japan | Ministry of Health, Labor, and Welfare (MHLW) and Pharmaceutical and Medical Devices Agency (PMDA) | I, II, III, IV | UDI implementiert
Die Unternehmen müssen die Pharmaceuticals and Medical Devices Act (PMD Act) einhalten. Das Registrierungsverfahren in Japan ist bekanntermaßen besonders langwierig, kostspielig und kompliziert. Weitere Informationen here. |
 |
Laos | Ministry of Health (MoH) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Weitere Informationen here. |
 |
Malaysia | Malaysian Medical Device Authority (MDA) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Vereinfachtes Registrierungsverfahren für Produkte, die bereits in den USA, der Europäischen Union, Australien, Japan oder Kanada zugelassen sind. Weitere Informationen here. |
 |
Myanmar | FDA of Myanmar | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Weitere Informationen here. |
 |
Pakistan | Drug Regulatory Authority of Pakistan (DRAP) | A, B, C, D | UDI nicht implementiert
Weitere Informationen here. |
 |
Philippinen | Food and Drug Administration of the Philippines (FDA) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Weitere Informationen here. |
 |
Singapur | Health Sciences Authority (HSA) | A (nicht steril), A (steril), B, C, D | UDI wird für Medizinprodukte der Klassen B, C und D verpflichtend sein, ab 2022 für implantierbare Produkte mit hohem Risiko Weitere Informationen finden Sie in diesem Leitfaden.ASEAN AMDD Mitglied.Weitere Informationen here. |
 |
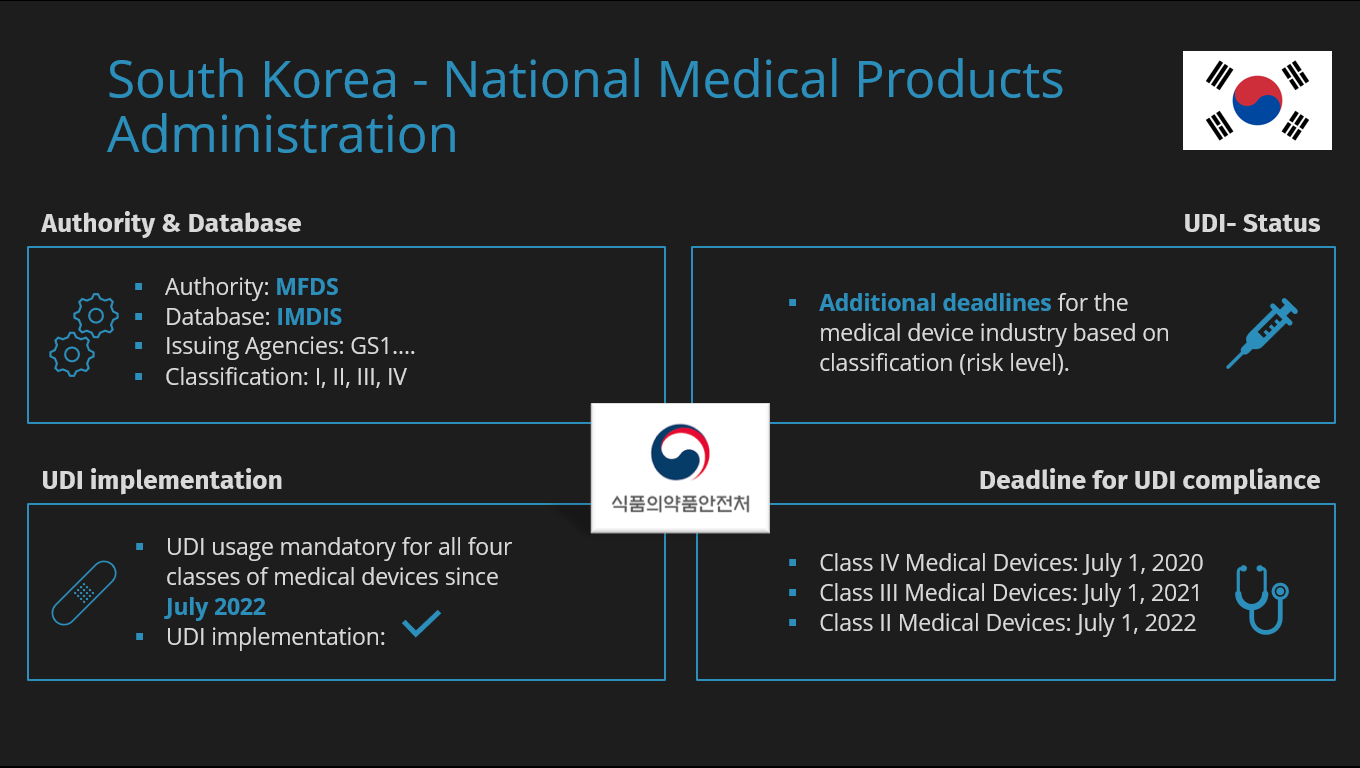
Südkorea | Ministry of Food and Drug Safety (MFDS) | I, II, III, IV | UDI implementiert Maschine-zu-Maschine-Übermittlung möglich.
Weitere Informationen here. |
| Thailand | Medical Device Control Division (MDCD) | 1, 2, 3, 4 | UDI nicht implementiert
ASEAN AMDD Mitglied. Weitere Informationen here. |
|
 |
Vietnam | Department of Medical Equipment and Health Works (DMEHW) | A, B, C, D | UDI nicht implementiert
ASEAN AMDD Mitglied. Weitere Informationen here. |
→ Wir haben eine Übersicht über die UDI weltweit (Stand Juli 2021) für 9 Länder veröffentlicht. Sehen Sie sich den Artikel an:






Related Posts